进来学!什么是荧光原位杂交(FISH)|MCE
- 上海皓元生物医药科技有限公司2026年1月29日 2:10 点击:21
一不小心你就会用到的——荧光原位杂交 (FISH)!一种实验室常用的分子技术,堪称检测染色体异常的 "金标准" !
Section.01
荧光原位杂交
(FISH) 技术
荧光原位杂交 (简称 FISH)——一种重要的细胞遗传学技术,该技术用于获取空间基因组和转录组信息。FISH 广泛应用于基因组学和细胞生物学研究,以及预防医学、生殖医学和肿瘤学等领域的诊断应用。
它是检测染色体异常的金标准技术!

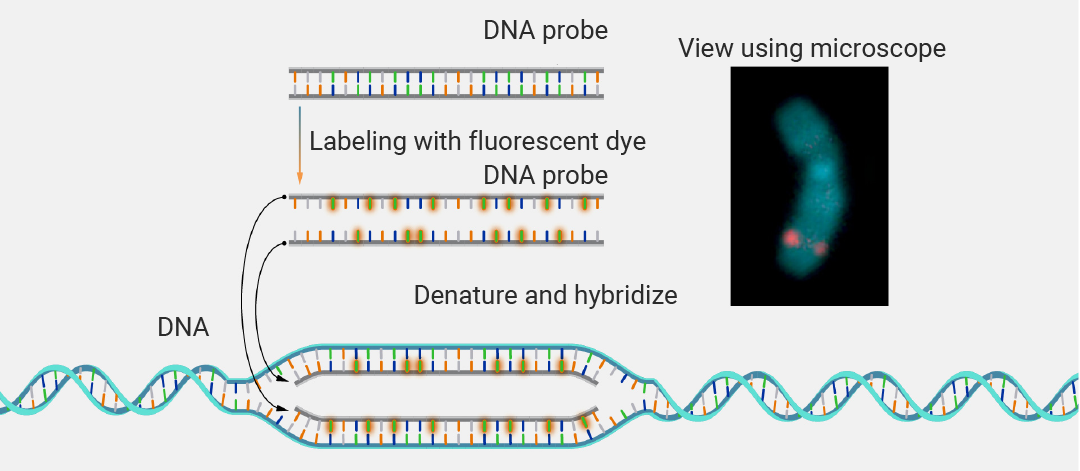
荧光原位杂交是一种用于检测和定位染色体上特定 DNA 序列的实验室技术。该技术将个体的全套染色体固定在载玻片上,然后用 "探针" (一小段标记有荧光染料的纯化 DNA)进行染色。荧光标记的探针会找到并结合染色体上的对应序列。借助专用显微镜,可以观察到荧光探针结合的染色体及其亚染色体区域。常用来确定结合了荧光探针的 DNA 区域、RNA 分子在染色体及其他细胞器中的定位 (图 1)。
? 高灵敏度与特异性:可精准检测并定位目标核酸序列,即便处于复杂细胞环境中,也能有效区分目标序列与非目标序列。
? 支持多色荧光标记:能够同时检测多个目标序列,显著提升检测效率与准确性。
? 直观可视化效果:借助荧光显微镜,可直接观察目标序列在细胞或组织内的分布及定位情况。
? 适用范围广泛:可应用于分裂与非分裂细胞,能够检测隐性基因缺失、基因易位及低水平基因嵌合体,且可在石蜡包埋组织 (PET) 切片上进行操作。
Section.02
实验流程
FISH 实验的核心步骤为:样品制备 →预处理 →杂交 →洗涤 →复染与封片 →荧光显微镜观察与分析。
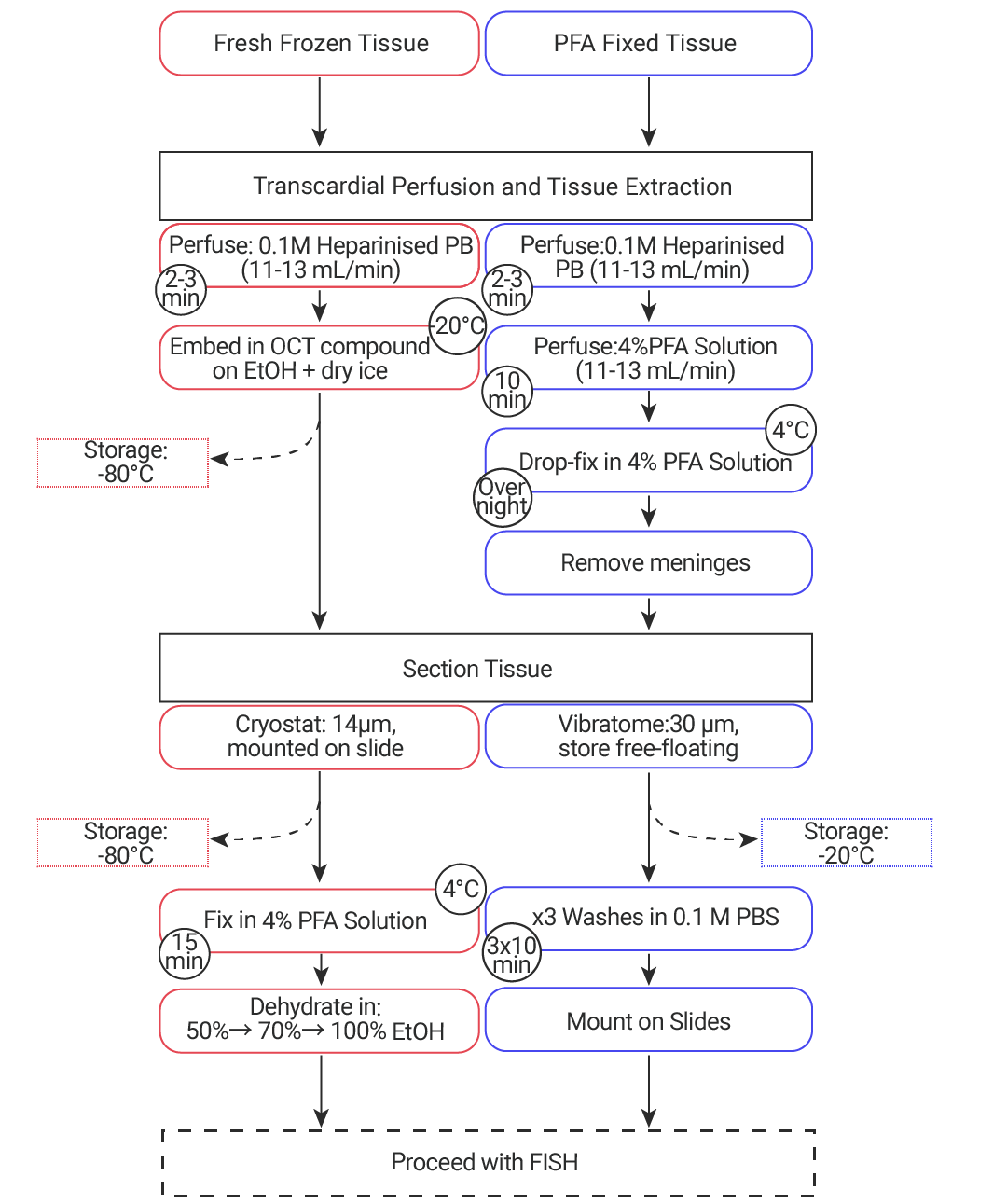
其中,样品预处理的关键在于暴露细胞或组织内的核酸,以确保探针有效结合,这一过程通常涉及蛋白酶消化与梯度乙醇脱水操作。组织预处理步骤见图 2。
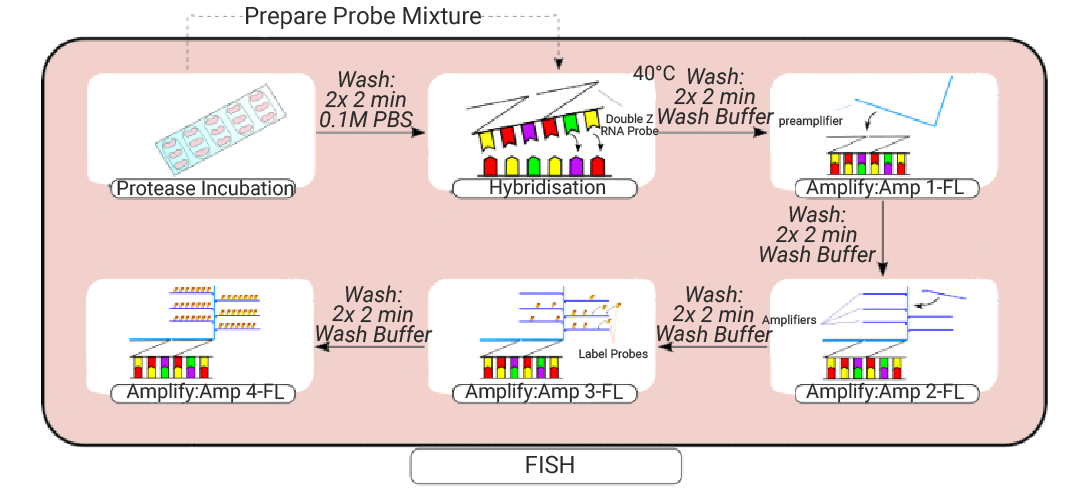
组织预处理完成后,使用疏水屏障笔对载玻片上的组织进行包膜处理 (圈画),随后置于蛋白酶溶液中室温孵育。洗涤后,将组织转移至台式培养箱杂交 2 小时,再依次进行扩增步骤。完成 FISH 探针处理后,组织需先进行洗涤,再用正常马血清封闭。一抗孵育在 4°C 条件下过夜进行,以确保抗体与抗原的充分结合;二抗孵育则在室温下持续 2 小时 (图 3)。
实验Protocol (供参考[3])
1. 制备标记有 DIG (或 FITC 等其他标记)的反义探针。
2. 对组织进行解剖,用 4% 磺酸钠溶液固定,并在 20% 蔗糖溶液中进行冷冻保护处理,然后迅速冷冻。
3. 切割冷冻切片,并将其收集在防脱载玻片上。让其干燥。
4. 将标记探针稀释至杂交缓冲液中的 1/1000 倍浓度。每张载玻片加入至少 300 微升,然后在上面放置一块干燥盖玻片,以使溶液均匀分布在切片上。
5. 在加湿的培养箱中于 65°C 下孵育过夜。
6. 移去盖玻片,在 MABT 缓冲液中洗涤 2 次,每次 5 分钟。
7. 接着在 65°C 下用 65°C 洗涤缓冲液洗涤 2 次,每次30 分钟。
8. 用 MABT 缓冲液洗涤2次,每次 5 分钟。
9. 用封闭液封闭 1 小时。
10. 将 AP-Anti-Dig 抗体稀释至封闭溶液中的 1/1500 倍浓度 (对于与过氧化物酶结合的抗体则为 1/500)。每张载玻片加入 500 微升,于 4°C 下孵育过夜。
11. 在 MABT 缓冲液中洗涤 3 次,每次 10 分钟。
12. 在 pH 9.8 的预显色缓冲液中短暂洗涤 (2 分钟即可)。
13. 在 pH 9.8 的显色缓冲液(含 5% PVA 和 NBT/BCIP) 中于 37°C 下孵育,让蓝色荧光达到到所需的强度 (2 小时至过夜),然后用自来水冲洗以终止反应。
14. 进行脱水处理,并用二甲苯基基质进行封片。
15. 使用荧光显微镜观察样品,识别并定位荧光信号。
上下滑动查看更多
相信涉及该实验的小伙伴大部分都会师承同门,先从“打下手” 的小跟班做起,再对着师兄师姐的实验记录本 “咔嚓” ,出师,迫不及待亲自尝试一番!
我知道你急,但咱先别急。上述只介绍了组织的处理步骤,如果你的样本是细胞,还是要乖乖做细胞爬片喔~
表1. FISH探针的主要类型。

Section.03
FISH 的技术联用
mRNA FISH 和 IHC 成像结合可用于表征 AD 模型中补体靶向疗法的疗效,或结合其他与阿尔茨海默病病理相关的蛋白聚集体 (如 tau、突触核蛋白) 研究基因表达。
『案例』:结合 FISH 和 IHC 检测小鼠大脑中淀粉样斑块胶质补体表达
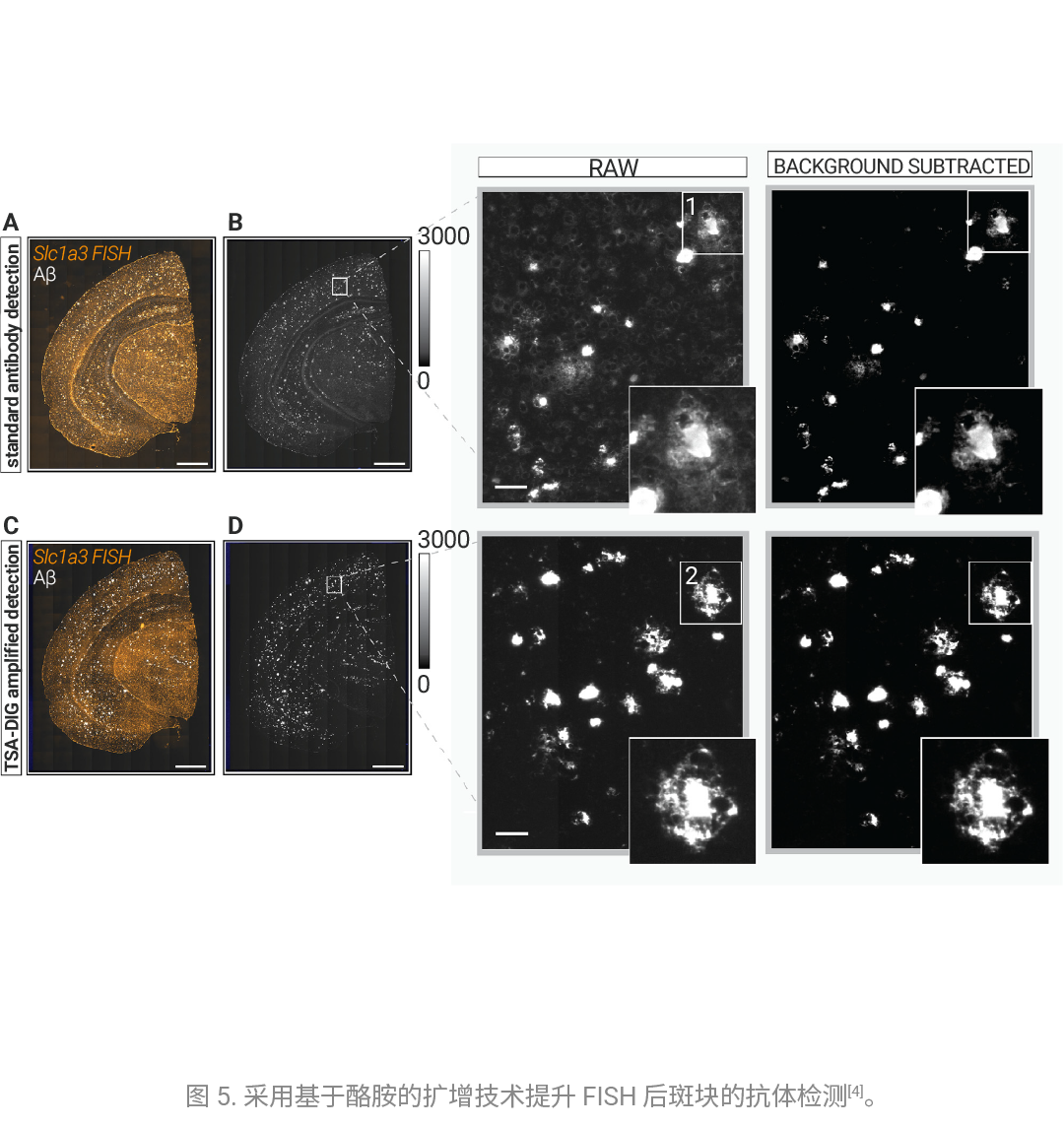
补体蛋白可促进阿尔茨海默病 (AD)的神经退行性病变,这类蛋白由包围 β- 淀粉样斑块的胶质细胞分泌。为此,作者提出了一种基于酪酰胺-地高辛(Tyramide-digoxigenin) 信号扩增技术的 Aβ 斑块检测优化方案 (如图 4)。该方案结合多重 mRNA 原位荧光杂交 (FISH) 技术,用于检测 TauPS2APP 小鼠模型中 Aβ 斑块近端区域胶质细胞特异性的补体表达情况。结果表明,通过信号放大处理,在连续的 FISH-IHC 实验中可获得更高的信噪比,并实现对弥漫性 Aβ 斑块的灵敏检测 (如图 5)。
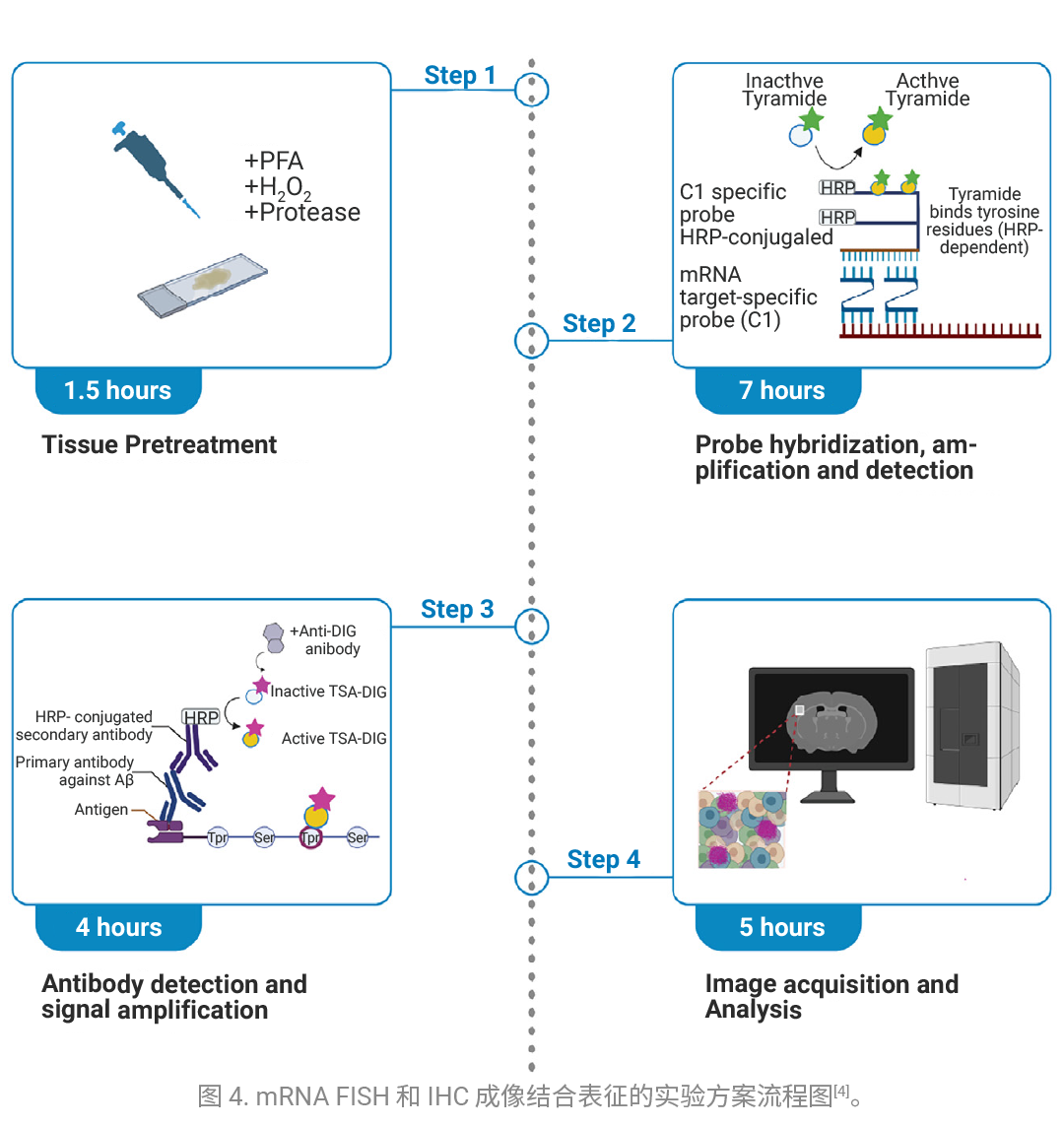
FISH-Flow
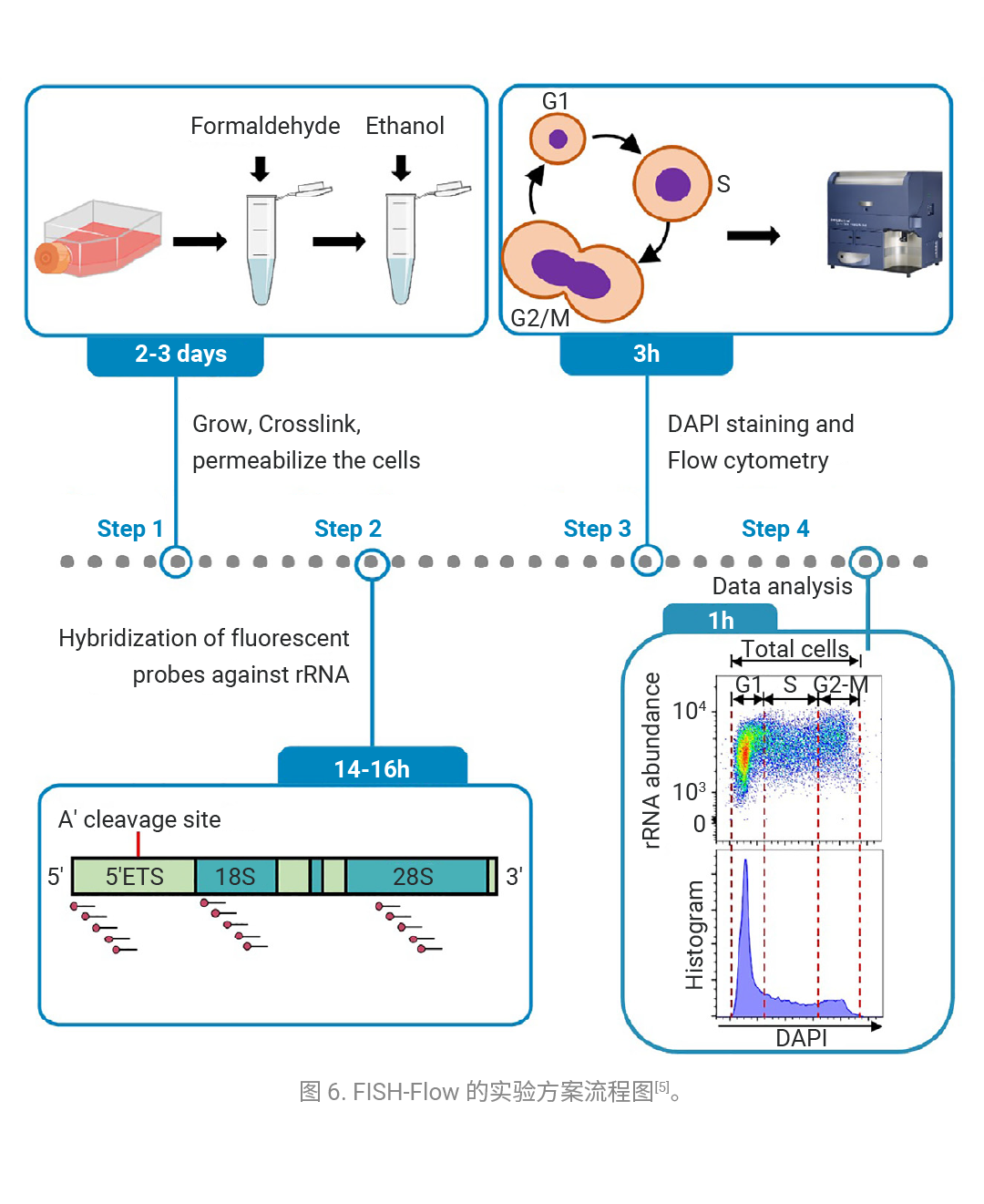
FISH-Flow 技术通过将荧光寡核苷酸与 RNA 杂交,借助流式细胞术实现单细胞层面的荧光定量分析。
『案例』:FISH-Flow 用于定量小鼠和人类细胞中新生和成熟核糖体 RNA。
研究人员开发了一种 FISH-Flow 方法,可用于定量小鼠和人类细胞中新生的 47S rRNA 以及成熟的 18S 和 28S rRNA,该方法还能结合 DNA 染色技术,完成跨细胞周期阶段的 rRNA 定量检测 (如图 6)。
无论是新生的还是成熟的核糖体 RNA 在细胞中都十分丰富。因此,如图 7A 所示,针对 rRNA 的 FISH 探针具有较高的信噪比。用 DNA 结合的 DAPI 染料进行染色,可将细胞群体分为 G1/S/G2-M 期,并对细胞周期各阶段的 rRNA 进行定量,如图 7B 所示。

序列荧光原位杂交 (seqFISH)
序列荧光原位杂交 (seqFISH,sequential fluorescence in situ hybridization) 是一种先进的生物分子分析方法,将成像技术与组合分子条形码技术相结合,利用已知序列的探针,对细胞/组织内的全 RNA 做多轮杂交成像,通过分析探针两臂区域 barcode 的荧光信号组合来判断基因 ID,讲特定位置信息与基因 ID 关联生成图像。seqFISH 方法能够在原生组织和器官环境中获得高分辨率的细胞类型、状态、和邻域关系信息 (图 8)。
Section.04
诺奖得主的最新研究:
smLiveFISH
就在今年!诺贝尔化学奖得主、CRISPR 基因编辑技术先驱 Jennifer Doudna 教授团队在Nature Biotechnology 期刊发表了题为 “Single-molecule live-cell RNA imaging with CRISPR–Csm” 的研究论文。该团队开发出一种单分子活细胞荧光原位杂交技术 (Single-molecule live-cell fluorescence in situ hybridization,smLiveFISH)。
smLiveFISH
【单分子活细胞荧光原位杂交技术】
该技术借助嗜热链球菌来源的 RNA 靶向 III-A 型 CRISPR-Csm 系统及多重向导RNA,使研究人员能够在包含原代细胞在内的多种细胞类型中,直接且高效地实现单个 RNA 分子的可视化,进而追踪不同种类活细胞中单个 mRNA 分子的动态轨迹 (图 9)。
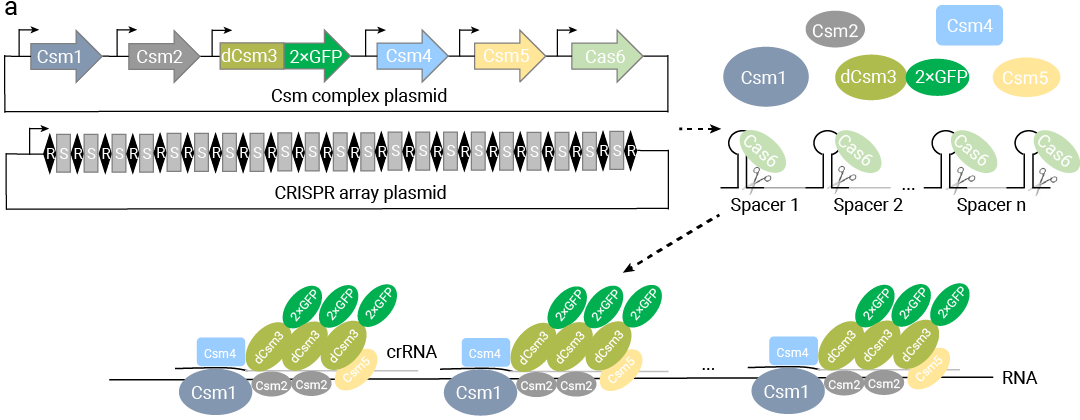
图 9. smLiveFISH 系统的工作示意图[7]。
如图所示,GFP 标记的 Csm 复合物标记单个 NOTCH2 mRNA (图 10 a 和 b 左图),smFISH 探针标记 NOTCH2 mRNA (图 10 a 和 b 中图),两者的叠加图像显示共定位情况 (图 10 a 和 b 右图)。Csm 复合物病灶与 smFISH 病灶的共定位比例、以及具有 Csm 复合物标记病灶的转染细胞比例均可进行量化 (图 10c-d)。
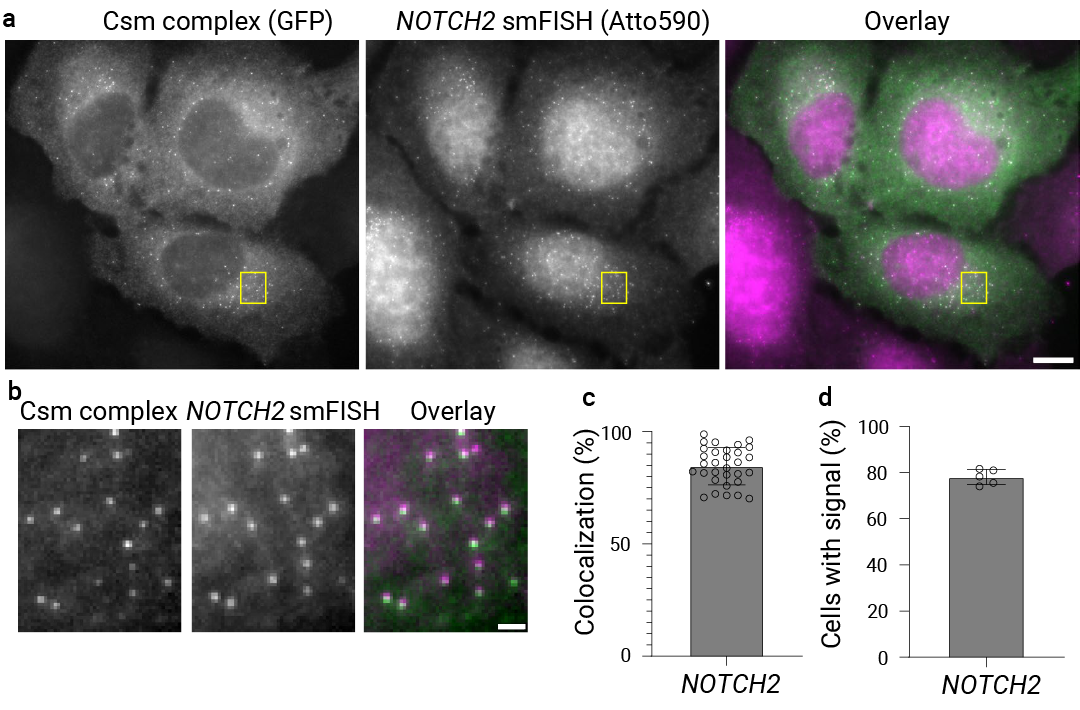
通过双色成像验证,Csm 复合物成功标记内源性 NOTCH2 mRNA,并在多种细胞类型中实现稳健检测,且未对 mRNA 的稳定性、衰变速率、定位及蛋白质表达产生影响。此外,smLiveFISH 技术也成功标记 MAP1B mRNA,通过共定位实验验证了信号的准确性,同时揭示其在细胞外围富集的空间分布特征,且同样未干扰 mRNA 的稳定性、衰变速率、定位及蛋白质表达,进一步证明该技术适用于不同 RNA 分子的可视化研究。
 文末小提示:置顶公众号,及时查收小 M 的定期推送喔~
文末小提示:置顶公众号,及时查收小 M 的定期推送喔~
产品推荐 |
Alexa fluor 488 azide ditriethylamine Alexa fluor 488 azide ditriethylamine 是一种多功能染料。 |
BODIPY-FL NHS ester (BODIPY FL, SE) 是一种能透过细胞膜的胺反应性荧光探针。 |
6-Fluorescein phosphoramidite 是一种有效的荧光染料。6-Fluorescein phosphoramidite 可用于标记寡核苷酸。 |
Cy3 phosphoramidite 是一种用于标记寡核苷酸的荧光染料。 |
Cy5 Phosphoramidite 是一种荧光染料,可用于寡核苷酸的合成。 |

[1] Debnath, et al. Molecular Diagnostics: Promises and Possibilities.Springer.2010;153-170.
[2] Dereli AS, et al. Combining Multiplex Fluorescence in situ Hybridization with Fluorescent Immunohistochemistry on Fresh Frozen or Fixed Mouse Brain Sections. J Vis Exp. 2021 Jun 25;(172).
[3] N.P. Pringle. et al. In situ hybridization protocols. https://www.ucl.ac.uk/%7Eucbzwdr/In%20Situ%20Protocol.pdf
[4] Rao S, et al. Protocol for detection of glial complement expression in relation to amyloid plaques in mouse brain with combined FISH and IHC. STAR Protoc. 2024 Dec 20;5(4):103388.
[5] Antony C, et al. FISH-Flow to quantify nascent and mature ribosomal RNA in mouse and human cells. STAR Protoc. 2023 Sep 15;4(3):102463.
[6] Chen A, et al. Spatiotemporal transcriptomic atlas of mouse organogenesis using DNA nanoball-patterned arrays. Cell. 2022 May 12;185(10).
[7] Xia C, et al. Single-molecule live-cell RNA imaging with CRISPR-Csm. Nat Biotechnol. 2025 Feb 18.



联系邮箱:kefu@labbase.net
版权与免责声明
- 凡本网注明“来源:来宝网”的所有作品,版权均属于来宝网,转载请必须注明来宝网, https://www.labbase.net,违反者本网将追究相关法律责任。
- 本网转载并注明自其它来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
- 如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。