免疫细胞治疗研究中常见的细胞因子作用机制
- http://www.abbkine.cn/promotion-cytokines-q32020年9月9日 3:30 点击:1472
最近几年,基因重组的细胞因子作为一种新型的生物应答调节剂在临床应用上取得了令人瞩目的成就。例如,最早用于临床的干扰素α在治疗白血病和病毒感染中收到显著疗效。中国的干扰素a1在1991年通过新药审评,已得到较为广泛的应用。目前已批准生产的细胞因子药还包括EPO、干扰素γ、GM-CSF、G-CSF、IL-2等。由于细胞因子为人体自身成分,通过调节机体生理过程和提高免疫力来治疗疾病,在低剂量即可发挥作用,因而疗效显著,副作用小是一种全新的生物疗法,将会很快获得突飞猛进的发展。
白细胞介素1(IL-1α、IL-1β):
IL-1α与IL-1β由不同的基因编码,在体内共用相同的受体,具有同样的生物学活性。IL-1可体外刺激CD4+T细胞的增殖,诱导IL-2的产生,共刺激CD8+/IL1R+T细胞活化,并刺激成熟的B细胞增殖和免疫球蛋白的分泌。
当IL-1α与IFN-γ和激活性CD3单抗合用时,可以明显提高CIK 的细胞毒作用。
白细胞介素2(IL-2):
白细胞介素2广泛应用于促进T细胞和NK细胞的活化和增殖。白介素2能够刺激NK细胞增殖、增加细胞毒作用并刺激NK细胞分泌多种细胞因子。
IL2活化T细胞的一个缺点是可以激活CD4+ FoxP3 Treg调节细胞。Treg可以抑制T细胞的活化和肿瘤杀伤。其次,白细胞介素2还可以诱导活化的T细胞凋亡。IL-2还会引起T细胞过度分化,形成杀伤能力较弱的老化T细胞。目前对IL2的观点认为它是T细胞的调节因子而不是纯粹的激活因子。因此逐渐有被其他白介素如IL7, IL15,IL21等取代的趋势。
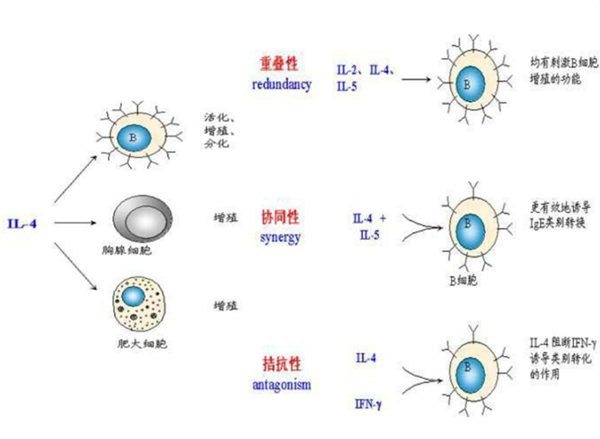
白细胞介素4(IL-4):
IL-4通过抑制巨噬细胞的生长,从而引导单核细胞向DC方向分化。培养体系中不加IL-4时单核细胞将分化为巨噬细胞。同时,IL-4还有降低细胞表面CD14分子的表达。CD14表达水平的降低是单核细胞分化为DC的重要标志。
白细胞介素-4的生物作用包括刺激活化B细胞和T细胞增殖、 CD4+T细胞分化成II型辅助T细胞,刺激Th2分泌IL-4, IL-5,IL-6, IL-10和IL-13。它也在调节体液免疫和适应性免疫中起关键作用,诱导B细胞抗体类别转换向IgE,上调MHC II的产生。
IL-4和GM-CSF 共同作用可使单核细胞定向分化为未成熟DC(immatureDC),此时的DC具有较强的抗原摄取和加工能力,但抗原递呈能力较弱。因此建议与促DC成熟的TNF-α顺序使用。
相对于IL4对Th2特异性的诱导作用,IL12可特异性诱导Th1的分化,从而维持长时程的抗肿瘤活性,在体外细胞培养中得到越来越多的应用。
白细胞介素7(IL-7):
白细胞介素7通过与白介2共用γc受体亚单位,刺激T细胞的存活增殖和维持。白介素7可以为Na07ve T细胞和记忆T细胞提供持续的刺激信号。相对于IL2的功能,IL7激活CD8+ T细胞而不会激活CD4+ FoxP3+ Treg细胞。在小鼠模型中,IL7可刺激抗原特异性T细胞的增殖,并在两项临床试验中应用。白介7的另一个临床应用为化疗或造血干细胞移植后用于恢复T细胞数量。
白细胞介素15(IL-15):
白细胞介素15通过与白介2共用γc受体亚单位,刺激T细胞的活化与增殖。白介素15的在免疫细胞治疗中的优势在于不会引起活化的T细胞凋亡。IL15在免疫治疗中的另一个特性是维持记忆性T细胞,从而对长期抗肿瘤活性中起到重要作用。白介15抗肿瘤的特性源于其对CD8+效应T细胞的刺激活性,同时IL15可活化NK细胞,NKT细胞和γδT细胞。
白细胞介素21(IL-21):
白细胞介素21与其他白介2家族成员一样通过一个特异性受体亚单位及IL2受体γc亚单位复合受体发挥其生物学功能。IL21的多种生物学效应包括:促进CD4+和CD8+ T细胞的增殖,增强CD8+ T细胞和NK细胞的细胞毒性而不引起活化产生的细胞凋亡。
IL21与IL2相比一个显著优势在于优先扩增CD27+CD28+的CD8+ T细胞。通常认为这一细胞类群是“年轻”的T细胞,具有更强的细胞毒作用。同时IL21不会引起Treg的扩增。由于IL21体外刺激抗原特异性T细胞产生和提高对抗原亲和力的卓越效果,在免疫细胞治疗中得到越来越广泛的应用。
白细胞介素12(IL-12):
白细胞介素12是活化的T细胞和NK细胞的生长因子。促进CD4+ T细胞分化为CD4+ Th1 T细胞,增强CD8+ CTLs细胞活性。白介12通过多种机制促进免疫细胞的肿瘤杀伤活性,其作用机制与剂量、时间、其他相互作用的细胞因子等有关。在小鼠抗黑色素体内模型中,高剂量的IL12通过NK细胞起作用,而低剂量的IL12则通过NKT起到肿瘤杀伤作用。
白细胞介素18(IL-18):
白细胞介素18能够刺激NK细胞和CD8+ T细胞分泌伽马干扰素(IFNγ),增强NK细胞与CD8+ T细胞的细胞毒作用。白介18的其他生物学作用包括促进巨噬细胞的活化,Th1 CD4+ T细胞的发育,促进淋巴细胞表达FasL等功能。
粒细胞巨噬细胞集落刺激因子(GM-CSF):
GM-CSF是发现最早的对于DC有作用的细胞因子之一。GM-CSF在DC培养中的功能是促进单核细胞向大巨噬样细胞分化,促进细胞表面MHC II类分子的表达,从而增强细胞的抗原递呈功能。此外,GM-CSF还可促进DC的存活。GM-CSF在多种肿瘤模型中表现出激活免疫反应的活性。GM-CSF抗肿瘤活性来源于其激活巨噬细胞和树突状细胞(DCs)的生物学功能。GM-CSF还能促进DC细胞成熟,促进共刺激分子上调和CD1d受体表达,从而参与抗原呈递功能。早期的研究表明CD4+和CD8+ T细胞参与了GM-CSF激活的抗肿瘤免疫。最近的研究表明GM-CSF参与的抗肿瘤活性中,NKT起到重要作用。
伽马干扰素(IFN-γ):
伽马干扰素属于II类干扰素可以激活巨噬细胞,诱导抗原呈递细胞(APCs)上的MHC I, MHC II和共激活分子表达。此外,伽马干扰素可以诱导蛋白酶体的表达变化从而增强抗原呈递能力。伽马干扰素还可以促进CD4+ T细胞向Th1分化,阻遏依赖于IL-4的B细胞亚型切换。伽马干扰素通过磷酸化JAK1和JAK2蛋白进而激活JAK-STAT细胞途径。
干扰素的免疫调节作用表现在对宿主免疫细胞活性的影响,如对巨噬细胞、T细胞、B细胞和NK细胞等均有一定作用:促进巨噬细胞MHCⅡ类分子的表达,增强其抗原递呈能力;促进B细胞和CD8+T细胞的分化,但不能促进其增殖;增强TH1细胞的活性,增强细胞免疫功能;增强中性粒细胞吞噬能力;活化NK细胞,增强其细胞毒作用;使某些正常不表达MHCⅡ类分子的细胞(如血管内皮细胞、某些上皮细胞和结缔组织细胞)表达MHCⅡ类分子,发挥抗原递呈作用。
肿瘤坏死因子(TNFα):
TNF-α可下调未成熟DC的巨胞饮作用和表面Fc受体的表达,上调细胞表面 MHC I类、II类分子和B7家族分子(CD80, CD86等)的表达,使未成熟DC分化为成熟DC(mature DC),此时DC的抗原摄取和加工能力明显减弱,而抗原递呈能力显著增强,可极强的激活T细胞。TNF刺激单核细胞和巨噬细胞分泌IL-1,增强IL-2依赖的胸腺细胞、T细胞增殖能力,促进IL-2、CSF和IFN-γ等淋巴因子产生,增强有丝分裂原或外来抗原刺激B细胞的增殖和Ig分泌。
品目 | 货号 | 规格 | 原价(元) | 特惠价(元) |
Human IFN-beta protein | 5ug | 700 | 490 | |
Human M-CSF protein, His Tag | 5ug | 700 | 490 | |
Human VEGF121 protein | 5ug | 700 | 490 | |
Human Leptin protein | 5ug | 700 | 490 | |
Human aFGF protein | 10ug | 700 | 490 | |
Human SCF (aa 1-189) protein, His Tag | 5ug | 700 | 490 | |
Rat BDNF protein | 5ug | 700 | 490 | |
Human BDNF protein | 5ug | 700 | 490 |
联系邮箱:kefu@labbase.net
版权与免责声明
- 凡本网注明“来源:来宝网”的所有作品,版权均属于来宝网,转载请必须注明来宝网, http://www.labbase.net,违反者本网将追究相关法律责任。
- 本网转载并注明自其它来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
- 如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。